【重磅】mRNA聯(lián)合免疫療法創(chuàng)奇跡 腦膠質(zhì)母細(xì)胞瘤治療進(jìn)入新紀(jì)元
近日,西京醫(yī)院臨床免疫科、神經(jīng)外科,空軍軍醫(yī)大學(xué)國(guó)家分子醫(yī)學(xué)轉(zhuǎn)化中心、細(xì)胞生物學(xué)教研室,啟辰生生物,約翰斯·霍普金斯大學(xué)醫(yī)學(xué)院藥理學(xué)與分子科學(xué)系,杜克大學(xué)醫(yī)學(xué)中心免疫學(xué)系的聯(lián)合研究團(tuán)隊(duì)發(fā)表預(yù)印版論文,題為“Combination Immunotherapy of Glioblastoma with Dendritic Cell Cancer Vaccines, Anti-PD-1 and Poly I:C: A Case Report”(腫瘤mRNA-DC疫苗、抗PD-1和Poly I:C聯(lián)合免疫治療腦膠質(zhì)母細(xì)胞瘤:一例病例報(bào)告)。提示該項(xiàng)研究對(duì)于聯(lián)合免疫療法在抗腫瘤治療領(lǐng)域的前瞻性和指導(dǎo)意義。

該研究是全球范圍內(nèi)首次報(bào)告應(yīng)用mRNA-DC疫苗、抗PD-1和poly I:C組成聯(lián)合免疫療法治療IV期腦膠質(zhì)母細(xì)胞瘤(GBM),并且達(dá)到預(yù)期目標(biāo):“最大限度地提高治愈的可能性”,最終患者超過(guò)5年的無(wú)進(jìn)展生存期結(jié)果令人鼓舞。研究中應(yīng)用全新的TriVac技術(shù)對(duì)mRNA編碼的腫瘤抗原進(jìn)行修飾,這也是mRNA技術(shù)優(yōu)于多肽類疫苗的優(yōu)勢(shì)之一。在臨床中TriVac技術(shù)修飾的mRNA表現(xiàn)出良好的安全性,并誘導(dǎo)出強(qiáng)大的抗腫瘤特異性CD4+和CD8+T淋巴細(xì)胞反應(yīng)。該研究結(jié)果表明,聯(lián)合免疫療法可以長(zhǎng)期進(jìn)行,并且安全性和有效性也得到了驗(yàn)證,為有效治療惡性程度極高的腦膠質(zhì)母細(xì)胞瘤提供了新的臨床治療策略和實(shí)證支撐。研究中所用的抗腫瘤mRNA-DC疫苗由啟辰生生物研發(fā),該產(chǎn)品已于今年10月18日獲得國(guó)家藥品監(jiān)督管理局藥品評(píng)審中心(CDE)受理臨床試驗(yàn)申請(qǐng),是國(guó)內(nèi)首個(gè)治療腦膠質(zhì)母細(xì)胞瘤的mRNA-DC細(xì)胞疫苗,將為腦膠質(zhì)母細(xì)胞瘤患者帶來(lái)新的希望。
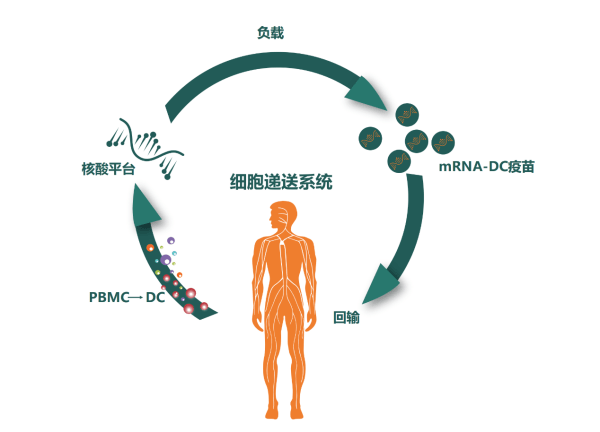
腦膠質(zhì)母細(xì)胞瘤是中樞神經(jīng)系統(tǒng)最常見(jiàn)的原發(fā)惡性腫瘤,因其惡性程度極高被稱為“新癌王”。國(guó)家衛(wèi)生健康委發(fā)布的《腦膠質(zhì)瘤診療指南(2022年版)》顯示:我國(guó)腦膠質(zhì)瘤年發(fā)病率為5~8/10萬(wàn),5年病死率極高,術(shù)后1年內(nèi)高復(fù)發(fā)。腦膠質(zhì)母細(xì)胞瘤作為一種起源于神經(jīng)膠質(zhì)細(xì)胞的腫瘤,約占所有中樞神經(jīng)系統(tǒng)惡性腫瘤的80%,其發(fā)病率在全球范圍內(nèi)持續(xù)上升。近年來(lái)在腦膠質(zhì)母細(xì)胞瘤的治療上進(jìn)展有限,患者的生存率很低,中位總生存期僅為13.5個(gè)月,是神經(jīng)外科診療中最具挑戰(zhàn)性的疾病。
基于樹突狀細(xì)胞(DC)的腫瘤mRNA疫苗是一種非常有前途的GBM治療方法。DC是目前已知體內(nèi)抗原遞呈功能最強(qiáng)的免疫細(xì)胞,也是特異免疫應(yīng)答的啟動(dòng)器,能高效攝取、加工、處理并呈遞抗原,是唯一能夠激活初始T細(xì)胞的專職抗原遞呈細(xì)胞,處于人體免疫應(yīng)答的中心環(huán)節(jié),因此被廣泛應(yīng)用于癌癥治療。
該預(yù)印本文章報(bào)道的臨床研究,采用患者自體DC細(xì)胞裝載多種形式的腫瘤抗原(包括:編碼TAA的mRNA,新抗原的mRNA和次氯酸氧化腫瘤裂解物),并與其他免疫治療藥物(包括:抗程序性死亡受體1(PD-1)抗體、免疫佐劑聚肌苷酸胞苷酸(poly I:C)等)聯(lián)合使用,以進(jìn)一步增強(qiáng)抗腫瘤活性。雖然此前有III期臨床研究應(yīng)用抗PD-1納武單抗聯(lián)合放化療治療GBM,但未能達(dá)到提高總生存期的目標(biāo)。本研究組合中,因成熟的DC細(xì)胞上調(diào)PD-L1和PD-L2,而且poly I:C激活免疫反應(yīng)的同時(shí)也刺激PD-L1和PD-L2在GBM腫瘤細(xì)胞上的表達(dá),因此有必要mRNA-DC腫瘤疫苗聯(lián)合抗PD-1以促進(jìn)納武單抗阻斷PD-L1/2在成熟DC細(xì)胞和GBM腫瘤細(xì)胞上的抑制信號(hào)被遞送到T淋巴細(xì)胞。這是一種創(chuàng)新型的聯(lián)合免疫治療策略,在此之前尚無(wú)此種聯(lián)合使用方式的報(bào)道。
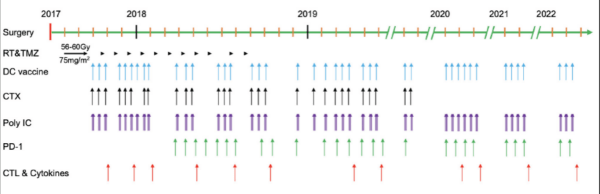
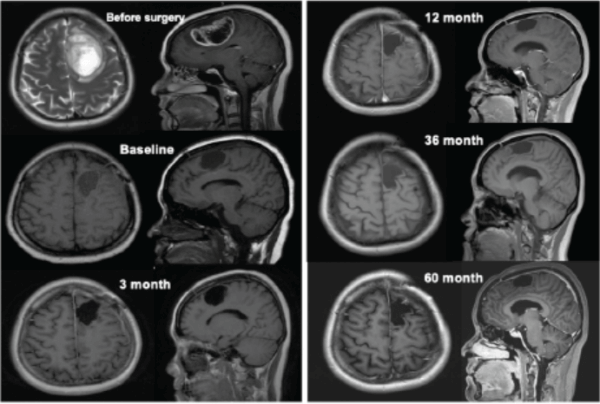
該患者的治療過(guò)程從2017年7月至2022年9月,超過(guò)5年,其中包括42次mRNA-DC腫瘤疫苗(連同poly I:C,每次mRNA-DC疫苗接種后給藥三次),以及抗PD-1藥物和低劑量環(huán)磷酰胺(以清除調(diào)節(jié)性T細(xì)胞)。臨床結(jié)果顯示,綜合免疫療法誘導(dǎo)出強(qiáng)大的抗腫瘤CD4+和CD8+T細(xì)胞反應(yīng),且在整個(gè)治療期間未觀察到免疫治療相關(guān)的不良事件。2022年7月21日的最近一次MRI掃描結(jié)果顯示沒(méi)有復(fù)發(fā)跡象。研究結(jié)果表明,整合到標(biāo)準(zhǔn)放化療中的聯(lián)合免疫療法對(duì)于長(zhǎng)期治療GBM安全并有效。
值得關(guān)注的是,該臨床研究除了采用全球首例mRNA-DC腫瘤疫苗/抗PD-1/poly I:C聯(lián)合免疫治療GBM以外,還使用了一項(xiàng)全新的TriVac技術(shù)對(duì)腫瘤抗原進(jìn)行功能修飾。該項(xiàng)技術(shù)由美國(guó)杜克大學(xué)和約翰斯·霍普金斯大學(xué)的科學(xué)家們發(fā)明,是將腫瘤抗原與一個(gè)不穩(wěn)定結(jié)構(gòu)域(DD)融合,同時(shí)將腫瘤抗原插入全長(zhǎng)的溶酶體相關(guān)膜糖蛋白1(LAMP-1)中,以分別增強(qiáng)主要組織相容性復(fù)合體(MHC)I類和II類抗原的呈遞。臨床研究中使用了7種TAAs,其中5種TAA(SOX11、PIM1、SP17、SOX3和CSPG4)的結(jié)果顯示,第一階段未經(jīng)此技術(shù)修飾其誘導(dǎo)的抗原特異性T細(xì)胞反應(yīng)相對(duì)較弱,而第二階段經(jīng)TriVac技術(shù)修飾后,誘導(dǎo)的抗原特異性T細(xì)胞反應(yīng)大幅度增強(qiáng)。另外兩種TAAs(MTFR2和ADAMTSL1)使用了TriVac技術(shù)修飾,用于治療的第二階段,誘導(dǎo)出非常強(qiáng)的抗腫瘤特異T淋巴細(xì)胞反應(yīng)。此結(jié)果表明TriVac技術(shù)在本次臨床試驗(yàn)中有突出表現(xiàn)。
另一個(gè)值得關(guān)注的發(fā)現(xiàn)是,通過(guò)研究對(duì)于mRNA編碼TAAs的抗腫瘤實(shí)際應(yīng)用有了新的認(rèn)知。為了最大限度地提高患者治愈的可能性,本次臨床研究使用了三種類型的腫瘤抗原(mRNA-TAAs,mRNA-新抗原和次氯酸氧化裂解物)來(lái)負(fù)載自體DC細(xì)胞。使用這些抗原可以極大的相互補(bǔ)充其在腫瘤疫苗中的作用。次氯酸氧化腫瘤裂解物具有增強(qiáng)免疫原性的作用,但受限于難以從腫瘤組織中獲取足夠量的腫瘤抗原長(zhǎng)期使用。本研究中患者的次氯酸氧化腫瘤裂解物僅足以支撐三次免疫接種,無(wú)法長(zhǎng)期治療。相比之下,體外合成的mRNA編碼TAA和新抗原可以提供無(wú)限量的供應(yīng)。在GBM治療中單獨(dú)使用新抗原會(huì)有兩個(gè)主要問(wèn)題:第一,GBM較低的腫瘤突變負(fù)荷使可供選擇的新抗原很少。本研究預(yù)測(cè)的10種新抗原中,僅有4種(PRKRIR,F(xiàn)LGN,HUWE1和RUNX1)產(chǎn)生了等于或大于野生型抗原誘導(dǎo)出的特異性T細(xì)胞反應(yīng),被用于負(fù)載自體DC細(xì)胞進(jìn)行免疫治療;第二,制造GMP級(jí)mRNA-新抗原并驗(yàn)證免疫原性需要花費(fèi)時(shí)間較長(zhǎng),通常需要3~6個(gè)月,而本次研究中使用的TAAs可預(yù)先制備,成本也極大降低。TAA免疫原性通過(guò)使用TriVac技術(shù)修飾等方法可有效增強(qiáng)MHC I類和II類抗原呈遞及T細(xì)胞刺激,遠(yuǎn)高于單獨(dú)使用TAA,并在產(chǎn)品可及性上更具優(yōu)勢(shì)。因此,考慮聯(lián)合使用mRNA-TAAs和mRNA-新抗原對(duì)于解決上述問(wèn)題應(yīng)是明智的選擇。
論文作者在討論中寫道:“本病例研究中我們觀察到幾個(gè)新穎的方面。第一,本病例代表了GBM治療中三種免疫治療藥物的首次聯(lián)合研究。盡管此前三種免疫治療藥物均已在GBM的治療中單獨(dú)進(jìn)行過(guò)測(cè)試,但全球范圍內(nèi)并沒(méi)有關(guān)于三者聯(lián)合使用的報(bào)道。第二,研究表明聯(lián)合免疫療法可以長(zhǎng)期進(jìn)行,并且安全性和有效性也得到了驗(yàn)證。本次研究的目的是測(cè)試聯(lián)合免疫療法的安全性和耐受性,并最大限度提高治愈的可能性。該患者超過(guò)5年的無(wú)進(jìn)展生存期的研究結(jié)果令人鼓舞。第三,不同形式的腫瘤抗原,包括mRNA-TAA、mRNA-新抗原和次氯酸氧化腫瘤裂解物,用于誘導(dǎo)抗腫瘤T淋巴細(xì)胞反應(yīng),可以相互補(bǔ)充,促進(jìn)腫瘤治療性疫苗療效。第四,基于TriVac技術(shù)的腫瘤抗原修飾技術(shù)表現(xiàn)出良好的安全性,并且在患者體內(nèi)誘導(dǎo)出強(qiáng)大的抗腫瘤特異性CD4+和CD8+T細(xì)胞反應(yīng)。”
10月13日,美國(guó)mRNA疫苗制造商Moderna宣布與制藥企業(yè)默沙東合作,聯(lián)合開(kāi)發(fā)并銷售一種個(gè)性化精準(zhǔn)治療癌癥疫苗(PCV)mRNA-4157/V940,與默沙東的抗PD-1藥物帕博利珠單抗(Keytruda,K藥)聯(lián)用,探索治療高危黑色素瘤。10月16日英國(guó)《衛(wèi)報(bào)》報(bào)道,德國(guó)生物技術(shù)公司BioNTech的創(chuàng)始人烏古爾﹒薩欣(U?ur ?ahin)和奧茲朗﹒圖雷利(?zlem Türeci)夫妻在接受BBC采訪時(shí)表示,針對(duì)癌癥的mRNA疫苗可能在2030年前上市。兩條消息引發(fā)全球?qū)τ趍RNA腫瘤疫苗的廣泛關(guān)注。10月18日,國(guó)家藥品監(jiān)督管理局藥品評(píng)審中心(CDE)官網(wǎng)信息,啟辰生生物科技(珠海)有限公司的靶向Survivin mRNA-DC細(xì)胞注射液臨床試驗(yàn)申請(qǐng)(IND)已獲受理(受理號(hào):CXSL2200520),成為國(guó)內(nèi)首個(gè)獲得受理的腦膠質(zhì)母細(xì)胞瘤治療性mRNA疫苗。國(guó)內(nèi)mRNA-DC腫瘤疫苗的研發(fā)進(jìn)度已處于和國(guó)際巨頭相當(dāng)?shù)乃健?/p>
未來(lái)攻克癌癥的策略是需要進(jìn)一步提高腫瘤mRNA疫苗的有效性和安全性,對(duì)于癌癥等復(fù)雜性疾病,沒(méi)有一種技術(shù)手段可以解決全部問(wèn)題,多學(xué)科綜合治療(MDT)的模式值得重視,聯(lián)合治療是必走之路。
推薦文章
-
發(fā)布時(shí)間:2025-07-21
-
發(fā)布時(shí)間:2025-07-21
-
發(fā)布時(shí)間:2025-04-07
-
發(fā)布時(shí)間:2025-04-07





